Primo principio della termodinamica
La variazione ΔU dell'energia interna di un sistema è uguale alla differenza tra il calore Q assorbito dal sistema e il lavoro L compiuto dal sistema:
ΔU = Q - L
Le leggi dei gas
Le relazioni tra le variabili di stato, dette leggi dei gas, definiscono completamente il comportamento di un gas in tutte le situazioni fisiche.
Secondo principio della termodinamica
Il secondo principio della termodinamica pone dei limiti ai processi permessi dal primo principio.
Seconda legge di Gay-Lussac
Indicando con p la pressione del gas alla temperatura t (misurata in °C), con p0 la pressione alla temperatura di 0°C e con α di un coefficiente di espansione, si ha:
p = p0 (1 + αt)
Legge di Boyle
A tempreratura costante, volume e pressione di un gas sono inversamente proporzionali:
pV = costante
Prima legge di Gay-Lussac
Indicando con V il volume del gas alla temperatura t (misurata in °C), con V0 il volume alla temperatura di 0°C e con α di un coefficiente di espansione, si ha:
V = V0 (1 + αt)
pa Va = pb Vb
pa : Ta = pb : Tb
Va : Ta = Vb : Tb
La termodinamica studia le leggi con cui i sistemi cedono e ricevono energia dall'ambiente; gli scambi di energia avvengono sotto forma di calore e lavoro; l'energia interna di un sistema aumenta o diminuisce se esso acquista energia dall'ambiente e viceversa.
Principio zero della termodinamica
Se un corpo A è in equilibrio termico con un corpo C e anche un corpo B è in equilibrio termico con C, allora A e B sono in equilibrio termico tra loro.
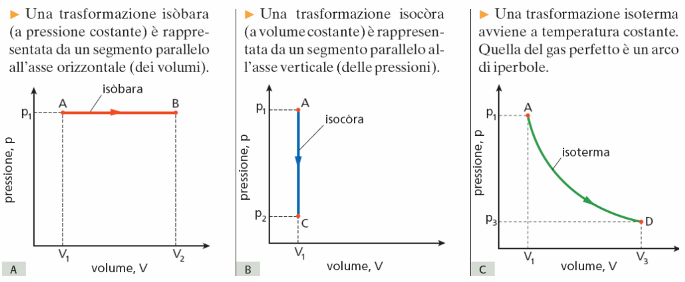
Le trasformazioni termodinamiche si possono rappresentare sul piano di Clapeyron
Altre trasformazioni quasistatiche importanti sono
le trasformazioni adiabatiche, in cui non ci sono scambi di calore tra il sistema e l'ambiente esterno e le trasformazioni cicliche, in cui lo stato finale del sistema coincide con quello iniziale.
Il lavoro in una trasformazione isobara è dato dal prodotto della pressione (costante) per la variazione di volume.
L = pΔV
Se il volume aumenta il lavoro è positivo, se il volume diminuisce il lavoro è negativo.
In una trasformazione isoterma la temperatura non varia, quindi non varia neanche l'energia interna.
ΔU = 0
In base al primo principio si ha allora Q = L
In una trasformazione isocora il volume non varia, quindi il gas non può né compiere né subire lavoro dall'esterno.
L=0
In base al primo principio si ha allora ΔU = Q
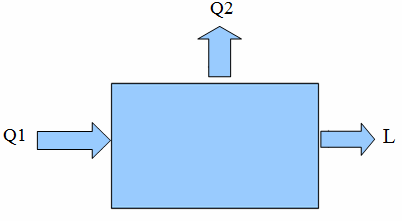
Le macchine termiche
Tutte le macchine termiche assorbono calore (Q2) da una sorgente calda, trasformano una parte di questo calore in lavoro meccanico (L) e cedono all'ambiente una certa quantità di calore residuo inutilizzato (Q1).
Il rendimento di una macchina termica
Il rendimento R di una macchina termica è dato dal rapporto tra il lavoro meccanico L prodotto dalla macchina e il calore Q2 assorbito dalla sorgente calda:
R = L/Q2
Il rendimento di qualsiasi macchina è sempre maggiore di 0 e minore di 1.
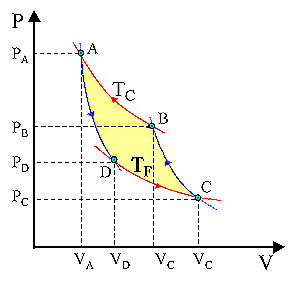
Il ciclo di Carnot
E' un ciclo termico costituito da due trasformazioni isoterme e da due adiabatiche applicato a un una macchina termica ideale.
Enunciato di Clausius
Non è possibile realizzare una macchina frigorifera il cui unico risultato sia quello di trasferire calore dalla sorgente più fredda a quella più calda.
Enunciato di Kelvin-Plank
Non è possibile realizzare una macchina termica il cui unico risultato sia quello di trasformare in energia meccanica il calore estratto da una sola sorgente.